Antibiotikaresistens - pågående evolution?
Artikeln är tidigare publicerad i Creation 39(4) 2017 sid 46-48.
Översatt av Torsten Lantz.

Artikeln är tidigare publicerad i Creation 39(4) 2017 sid 46-48.
Översatt av Torsten Lantz.
Bakterieresistens mot antibiotika har blivit ett ökande bekymmer inom hälsovården på grund av överanvändning av dessa läkemedel. Men hur uppstår resistens, och är det verkligen bevis för att bakterier kan utvecklas till människor och allt annat levande? Författaren tittar närmare på vad som egentligen händer i ett antal olika fall av antibiotikaresistens hos bakterier.
I samtliga fall visar det sig att de mutationer som leder till resistens är nedbrytande processer. Det kan handla om att bakterien inte längre kan tillverka en viss substans eller att regleringen av någon process slutar fungera, vilket i sin tur leder till att det blir brist på ett ämne eller att tillverkningen av det ”skenar”. Sådana mutationer kan leda till att bakterier överlever i en miljö där de annars inte skulle gjort det, och förändringen räknas som fördelaktig (ur bakteriens perspektiv). Men förändringarna som sådana är nedbrytande till sin natur och kan därför inte användas som argument för en evolution som fått rykte om sig att bygga människor av bakterier.
Ett av de viktigaste framstegen inom det medicinska området har varit upptäckten av antibiotika, något som medfört en genomgripande förbättring av hälsovården. Bakterieinfektioner, som exempelvis tuberkulos eller infekterade öppna sår, innebar tidigare ofta att patienten dog. Nu kunde man behandla sjukdomen och därmed rädda miljontals liv
Under de närmaste 15 åren, efter att man börjat använda antibiotika, minskade de sjukdomsrelaterade dödsfallen i USA med 220 per 100 000 invånare och år. All annan medicinsk teknik som tillfördes under de följande 45 åren medförde bara en minskning av ytterligare 20 per 100 000.
Den här framgången hotas emellertid av den pågående utvecklingen av antibiotikaresistens. Infektioner, där de orsakande bakterierna blivit resistenta mot flera eller alla tillgängliga antibiotika, ökar nu globalt. Det är också färre företag som arbetar med utveckling av nya antibiotika. År 1990 fanns det 18 sådana företag, men år 2011 endast fyra. En avgörande orsak till nedgången är att man ser att resistens ganska snart börjar utvecklas mot ett nyintroducerat antibiotikum samt att nyutvecklingen kostar mycket pengar. År 2015 meddelades för första gången sedan 1987 upptäckten av en ny klass antibiotika.
De läroböcker som används i skolor och på universitet framställer ofta antibiotikaresistens som ett exempel på ”pågående evolution” – som evidens för att mikrober kan förändras till mikrobiologer på några miljarder år. När man studerar de biokemiska mekanismer som ligger till grund för utvecklingen av resistens får man inte fram något stöd för en sådan bild av stora evolutionära förändringar. De förändringar som man upptäcker stöder en kreationistisk syn på livet – där begränsade förändringar inte kan ändra en slags grundorganism till en annan.
 Forskarna har upptäckt tre olika sorter av resistens:
Forskarna har upptäckt tre olika sorter av resistens:
Kolistin (också känt som polymyxin E) ger oss ett gott exempel. Det är en positivt laddad molekyl som fäster vid de negativt laddade molekyler (lipopolysackarider eller LPS) som finns i yttre membranet hos vissa bakterier (de gramnegativa). Bindningen är ett viktigt första steg i den process som ska avdöda bakterierna.
Vissa bakterier är muterade så att de inte kan producera LPS. Då förhindras kolistinet att binda till målmolekylen vilket medför att bakterien inte kan avdödas.
Det finns också mera komplexa mekanismer som kan förhindra bindningen. Positivt laddade magnesiumjoner – som binder till den negativt laddade LPS:en – stabiliserar normalt cellmembranet hos den här sortens bakterier. När magnesiumkoncentrationen är låg har bakterierna ett system för att maskera den negativa laddningen, för att hålla membranet stabilt. Maskeringen kontrolleras av cellen, som bara slår på den när den behövs. En mutation kan dock skada styrsystemet så att maskeringssystemet alltid står påslaget. Cellen kan då inte stänga av maskeringen.
Även här orsakar den minskade exponeringen av negativ laddning att antibiotikan förhindras att binda till cellen för att avdöda bakterien. I det här fallet förslösar cellen resurser på ett system som normalt inte behövs, vilket innebär att sådana bakterier överlever sämre i det vilda där antibiotikumet saknas. Hur man än ser på det så är det så att mutationerna förstör existerande funktioner i stället för att skapa några nya med nya enzymer/proteiner.
Vissa typer av antibiotika måste transporteras in i bakterien för att det ska uppnås en avdödande effekt. Ett exempel på detta är fosfomycin, som avdödar bakterier genom att hindra dem från att tillverka en nödvändig del av sin cellvägg. I cellväggen finns olika transportpumpar som ser till att näringsämnen kan komma in i cellen. Fast transportörerna är mycket bra på att sortera ut vad de ska transportera, är fosfomycinet till sin struktur så likt en del av de vanliga näringsämnen de tar upp, att det ”åker snålskjuts” in genom membranet.
Mutationer i de gener som specificerar hur cellen ska tillverka transportörer - eller mutationer i de reglergener som stimulerar till produktionen – kan få till effekt att det inte bildas några transportörer, eller mindre effektiva sådana. Det betyder att inget alls, eller bara lite, av fosfomycinet kommer in i cellen. Sådana celler har fått resistens mot fosfomycin.
Vi vill återigen betona att mutationer förstör cellens normala funktion; de skapar inga nya gener och proteiner/ enzymer. Långt ifrån att ha blivit en ”ny förbättrad modell” är det istället så att de resistenta cellerna inte längre klarar av att ta upp nödvändiga näringsämnen. De transportörer som skulle sköta detta arbete är ju trasiga – eller så finns de inte alls. Så i en miljö utan antibiotika konkurrerar de mottagliga bakterierna ut de resistenta, som därför bara utgör en liten andel av den totala bakteriepopulationen.
Många bakteriearter har pumpar som trycker ut vissa ämnen, som till exempel gifter, ur cellen. De kallas ”utloppspumpar” och kan pumpa ut antibiotikan ur cellen och därmed förhindra bakteriens avdödning. Regleringen av de gener som sköter tillverkningen av utloppspumpar är komplex. Men om de regulatorer som begränsar antalet tillverkade pumpar blir muterade, kan det innebära att ett överskott av pumpar blir tillverkade – och att cellen då blir resistent mot något antibiotikum. Den här resistensformen har särskilt stor betydelse för antibiotika som tillhör klassen fluorokinoloner. Observera också att bakterieceller med detta trasiga reglersystem, slösar bort resurser genom att tillverka överflödiga pumpar, och mutanterna får därigenom sämre överlevnadsförmåga i miljöer där detta antibiotikum saknas.
I alla de nämnda fallen ”förstör” mutationer gener för de pumpar eller de system som reglerar deras tillverkning. Detta kan inte användas som stöd för att mutationer skapar de nya gener som krävs för att evolutionen ska gå framåt från bakterier till mikrobiologer.
 Bakterier kan tillverka enzymer som bryter ner (metaboliserar) ett antibiotikum. Till exempel finns det enzymer som heter beta-lactamaser och som kan bryta ner penicilliner. Man skulle kunna tycka att en bakterie som, när den möter ett antibiotikum, utvecklar den här förmågan borde vara ett bra exempel på evolution – nytt enzym och ny gen. Fast man har aldrig sett någon process där en mekanism för tillverkning av antibiotikanedbrytande enzymer uppkommit genom mutationer. Men hur gick det då till?
Bakterier kan tillverka enzymer som bryter ner (metaboliserar) ett antibiotikum. Till exempel finns det enzymer som heter beta-lactamaser och som kan bryta ner penicilliner. Man skulle kunna tycka att en bakterie som, när den möter ett antibiotikum, utvecklar den här förmågan borde vara ett bra exempel på evolution – nytt enzym och ny gen. Fast man har aldrig sett någon process där en mekanism för tillverkning av antibiotikanedbrytande enzymer uppkommit genom mutationer. Men hur gick det då till?
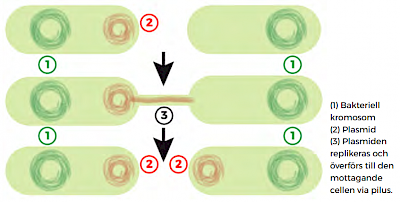
Det är nu känt att en bakterie kan få förmågan att bryta ner ett antibiotikum överförd från en annan redan resistent bakterie. Sådana resistensgener kan ligga på de små ringformade DNA-molekyler som kallas plasmider och som ligger utanför bakteriens kromosomer. Sådana plasmider kan överföras mellan olika bakterier, till och med om de tillhör olika arter. I en process som kallas konjugation kopplar sig en bakterie med resistent plasmid till en utan via ett rör (pilus) (se bild på förgående sida). Den resistenta bakterien ”donerar” här en kopia till den sårbara mottagarcellen. Många plasmider innehåller flera olika resistensgener, som var för sig har effekt på olika typer av antibiotika. Och inte heller i den här resistenstypen är det några nya gener inblandade, utan bara befintliga gener som överförs från den resistenta typen till den icke-resistenta.
Ett klassiskt exempel är här penicillinresistens. En del bakterier producerar små mängder av penicillinas, ett enzym som bryter ned de små mängder av penicillin som finns i deras närmiljö. Mängderna är då för små för att få någon inverkan på patienterna med tanke på de mängder av antibiotika som ges till dem. Men en mutation i det system som begränsar tillverkningsmängden av enzymet kan medföra att det tillverkas så mycket att bakterien blir resistent.
Men som i de tidigare nämnda fallen gäller att de resistenta bakterier som inte kan styra sin produktion av penicillinas, blir utkonkurrerade när de ska samsas med bakterier som inte förslösar sina resurser på onödig produktion av enzymet.
I samtliga nämnda fall skulle det naturliga urvalet kunna gynna de resistenta stammarna när det finns mycket antibiotika i närheten. Fast även om det naturliga urvalet kan förklara hur resistensen kan bestå, så förklarar det inte hur den kom dit från början. Resistensen uppstår när ett befintligt system modifieras (vanligtvis genom att det går sönder), eller när gener överförs från bakterier som redan har dem. Om en funktion förstörs genom mutationer så tenderar det naturliga urvalet att eliminera de resistenta stammarna i vildmiljön, medan det gynnar dem i en miljö som är mättad av antibiotika.
Forskningen om antibiotikaresistens har visat några bra exempel på hur mutationer och naturligt urval kan hjälpa en bakterie att anpassa sig till antibiotika. Ingen av upptäckterna stöder dock tanken på att slumpmässiga förändringar (mutationer) av befintliga gener skulle kunna åstadkomma alla de tusentals nya gener och nätverk som skulle behövas för att förvandla mikrober till människor, mangoträd eller minkar. Faktum är att de förändringar man studerat understryker hur begränsade mutationer är när det gäller ”framåtskridande” evolution.

Denna artikel är tidigare publicerat i magasinet Genesis 2018/1, med temat "Är evolutionsteorin bevisad?".
PrenumereraFler nummer





